发表在《Cancers (Basel》的一项体外研究,评估了二甲双胍和依维莫司联合用药对NET细胞增殖、凋亡、集落形成、细胞活力、NET球形生长以及Akt和mTOR通路的影响,并培养耐依维莫司的NET细胞以进一步研究该联合用药。
该研究发现,二甲双胍联合依维莫司在抑制胰腺NET(PAN-NET)细胞增殖方面优于单药治疗(-71%±13%,p < 0.0001),而对肺神经内分泌肿瘤(PNT)细胞增殖无叠加作用。联合治疗在抑制两种细胞系的集落形成、细胞存活率、NET球形生长速率和mTOR磷酸化方面均比单药治疗更有效。在PAN-NET细胞系中,二甲双胍不影响Akt的磷酸化;相反,它显著降低了PNT细胞系中Akt的磷酸化水平。通过对依依维莫司耐药的NET细胞的研究证实,二甲双胍通过两种不同的途径维持其作用:依赖于Akt或不依赖于Akt,这取决于细胞类型,两者都会导致mTOR抑制。
该研究提示,依维莫司和二甲双胍联合应用于NET细胞的良好效果,该研究这为依维莫司与二甲双胍联合在NET患者中的应用提供了理论依据。
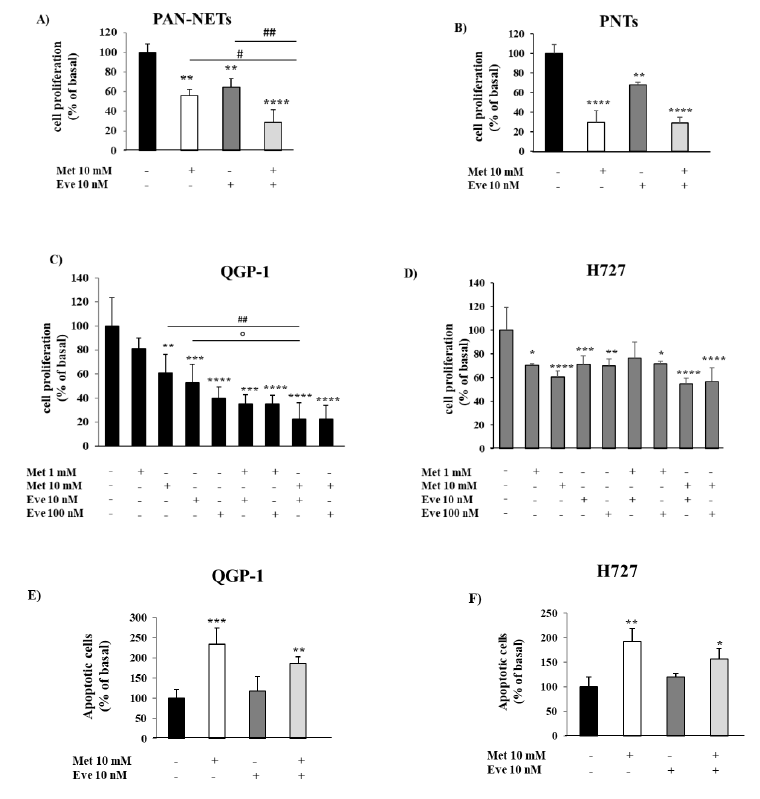
图1. 二甲双胍和依维莫司对神经内分泌肿瘤细胞增殖和凋亡的影响。(A,B)为了测量细胞增殖,该研究用二甲双胍10mm和依维莫司10nm单独或联合培养原代NET细胞24小时,然后用BrdU培养24小时。(C,D)为了测量细胞增殖,QGP-1和H727细胞系分别与二甲双胍(1-10 mM)和依维莫司(10-100 nM)单独或联合培养24小时,然后用BrdU处理2小时。(E,F)该图显示了二甲双胍(10mm)和依维莫司(10nm)单独或联合治疗后凋亡细胞的百分比。只有二甲双胍10mm能显著提高细胞凋亡率。
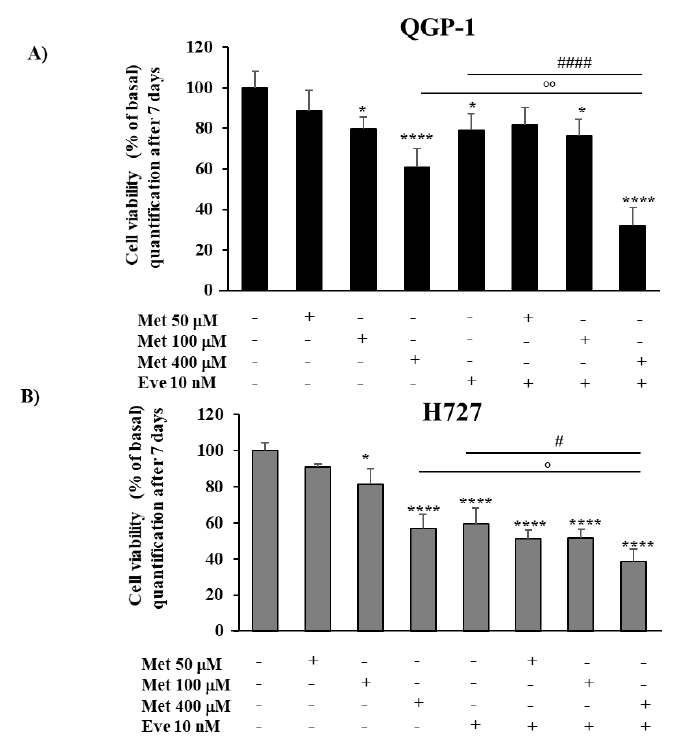
图2. 二甲双胍(Met)和依维莫司(Eve)对QGP-1和H727细胞活性的影响。(A, B)将细胞与二甲双胍(50μm、100μm、400μm)孵育,依维莫司(10 nM)处理,或依维莫司(10 nM)与二甲双胍(50μm、100μm、400μm)联合处理7天。与单药相比,二甲双胍400μm和依维莫司10nm联合治疗可有效降低两种细胞系的生存能力。
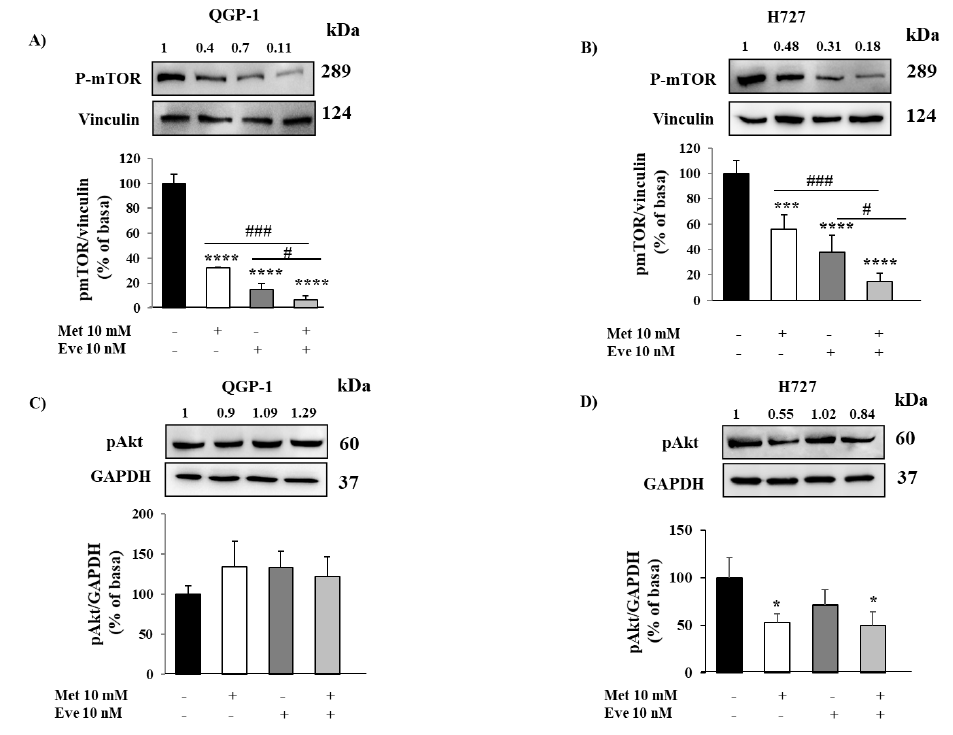
图3. 二甲双胍(Met)和依维莫司(Eve)对QGP-1和H727细胞mTOR和Akt磷酸化的影响。(A,B)磷酸化mTOR的代表性免疫印迹显示,在两种细胞系中,二甲双胍和依维莫司联合应用对mTOR的抑制作用比各药单一疗法更有效。(C)磷酸化Akt的免疫印迹显示二甲双胍不影响QGP-1细胞系中Akt的磷酸化。图中显示了标准化为管家基因GAPDH的定量磷酸化Akt (3个独立实验的平均值±SD)。(D)磷酸化Akt的免疫印迹显示二甲双胍显著降低H727细胞株Akt磷酸化。
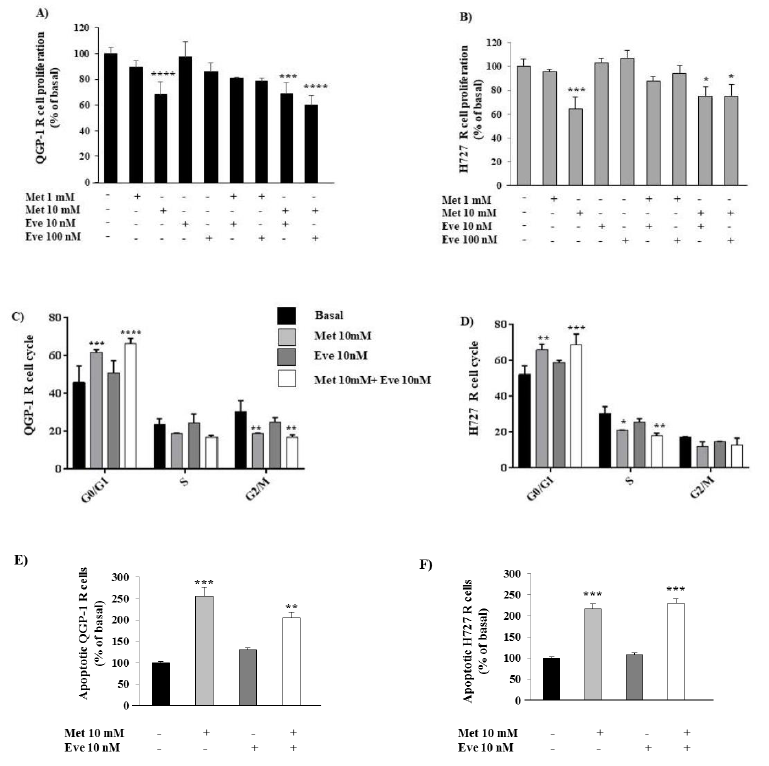
图4. 二甲双胍(Metformin,Met)继续在QGP-1-R和H727-R细胞的增殖、细胞周期和凋亡中发挥其抗癌作用。(A,B)用二甲双胍(1~10 mM)和依维莫司(Eve 10~100nm)或两者联合作用24 h,然后用BrdU处理2 h,观察细胞增殖情况。(C,D)用二甲双胍(10mm)和依维莫司(10nm)或两者联合作用24h后,用流式细胞仪分析细胞周期。(E,F)与QGP-1-R和H727-R细胞基础值相比,单独或联合使用二甲双胍(10 mM)和依维莫司(10 nM)治疗后凋亡细胞的百分比。只有二甲双胍10mm能显著促进细胞凋亡。
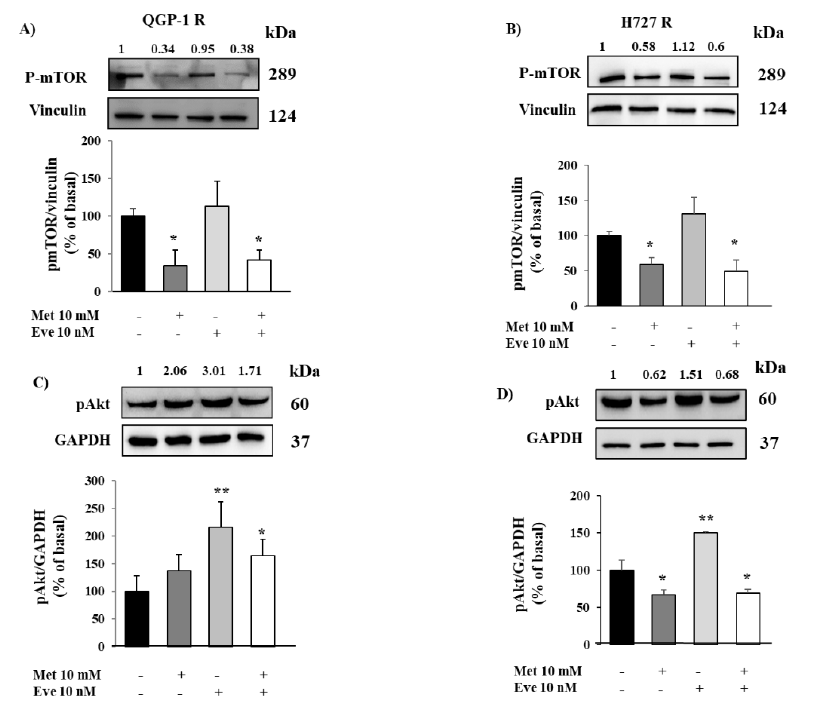
图5. 二甲双胍(Met)对QGP-1-R和H727-R细胞mTOR和Akt磷酸化的影响。(A,B)磷酸化mTOR的免疫印迹显示二甲双胍继续抑制依维莫司耐药QGP-1-R和H727-R细胞的mTOR磷酸化。(C,D)二甲双胍和依维莫司单独或联合孵育后p-Akt的免疫印迹。二甲双胍对QGP-1-R细胞的Akt磷酸化没有影响,相反,H727-R细胞的p-Akt显著降低。
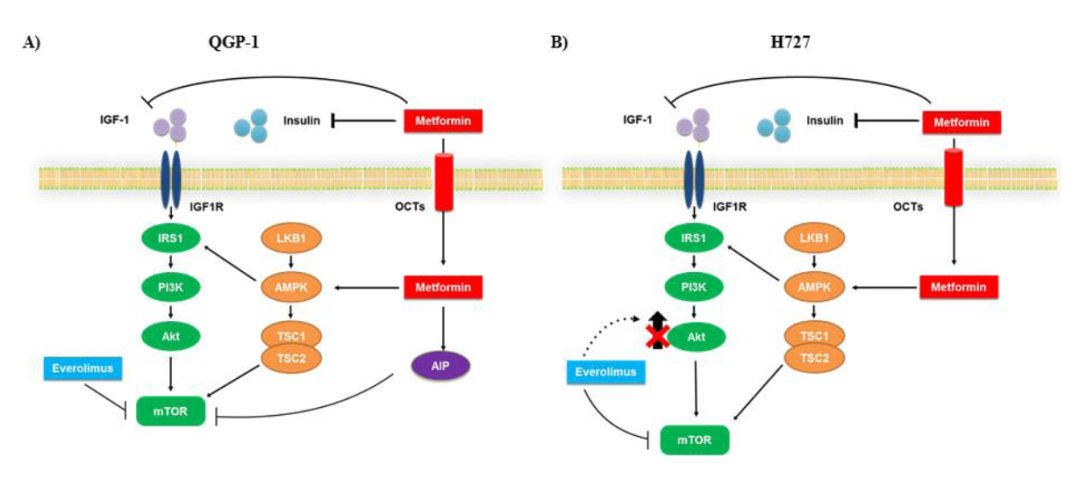
图6. 二甲双胍和依维莫司对QGP-1和H727细胞作用机制的示意图。二甲双胍通过50-AMP活化蛋白激酶(AMPK)依赖或独立的途径发挥作用,导致mTORC1复合物抑制。依维莫司抑制mTOR磷酸化,但其长期使用受到耐药性发展的限制,可能是由于Akt信号的激活。二甲双胍和依维莫司联合应用可诱导更有效的mTOR阻断,并可能抵消依维莫司引发的耐药机制。(A)在QGP-1细胞中,二甲双胍不抑制Akt磷酸化,可能通过AIP途径降低mTOR磷酸化。(B)在H727细胞中,二甲双胍降低Akt磷酸化以抑制mTOR磷酸化。





 京公网安备 11010502033352号
京公网安备 11010502033352号